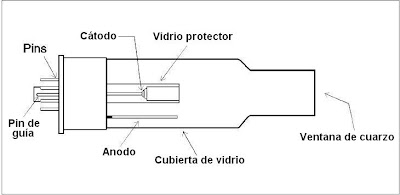
El término espectroscopia significa la observación y el estudio del espectro, o registro que se tiene de una especie tal como una molécula, un ion o un átomo, cuando estas especies son excitadas por alguna fuente de energía que sea apropiada para el caso.
Uno de los pioneros en la espectroscopia fue Isaac Newton, quien a principios de 1600 observó y estudió el comportamiento de la luz solar cuando esta atraviesa por un prisma.


En 1831, J.F. Herschel demostró, que las sales de diferentes metales producen distintas coloraciones a la flama cuando las sales disueltas o en forma directa son puestas en contacto con ésta. Así por ejemplo la sales de calcio dan a la flama un color naranja, las de sodio un color amarillo, las de potasio un color violeta, las de cobre un verde azulado, las de estroncio un color verde amarillo, etc. Estas observaciones fueron corroboradas posteriormente por otros investigadores sugiriendo que de esta forma podría identificarse el metal formador de la sal en un compuesto químico específico.
Kirschoff y Bunsen en 1859 ampliaron el conocimiento de la naturaleza de este fenómeno, cuando la luz colorida producida por el metal en la flama la hicieron incidir en un depósito óptico que separa la radiación emitida por el metal, de la luz solar. En éste instrumento que fue llamado espectroscopio (espectroscopio= observación del espectro).
Se observa que cada metal que emite radiación de diferente color, presenta líneas que aparecen en diferentes posiciones en la pantalla o campo de observación, y esto es independientemente de las condiciones en que se realiza el experimento así como de la naturaleza de la sal metálica y únicamente depende del metal. Adicionalmente, la intensidad de la línea está directamente relacionada a la concentración del elemento en solución.
De esta manera se tiene una forma inequívoca de identificar el elemento ( Por la posición de sus líneas ),así como una manera de identificar éste (por la intensidad de las líneas producidas).
A principios del siglo XX no se conocían todos los elementos de la tabla periódica y frecuentemente se incurría en errores, al dar por descubiertos elementos nuevos cuando en realidad eran elementos ya conocidos.
Gracias al desarrollo de la espectroscopia cuando se daba la noticia de haber encontrado algún elemento nuevo, se observaba su espectro. Si este ya coincidía con los elementos ya conocidos se descartaba la novedad del elemento, si por el contrario no coincidía con ninguno de los espectros de elementos ya conocidos la prueba era inobjetable y se consideraba uno más de la lista de elementos químicos.
Aunque las aplicaciones de la espectroscopia en el análisis cualitativo fueron casi inmediatas, su utilidad en el aspecto cuantitativo tuvo que esperar muchos años, ya que el desarrollo científico y tecnológico de ese momento era insuficiente.
A pesar de que como se ha mencionado antes, el potencial de la espectroscopia en el análisis cuantitativo era conocido desde fines del siglo pasado, su desarrollo y amplia aplicación en el análisis químico es tan reciente que apenas en 1952 tuvo desarrollo el
primer equipo comercial de espectroscopia de absorción atómica para la cuantificación de metales.
Esta lentitud en la adaptación de técnicas espectroscópicas al análisis químico cuantitativo ha sido compensada por el alto grado de desarrollo que ha alcanzado en los últimos años.
Bibliografía:
SKOOG, D.A. James; Holler F. James; PRINCIPIOS DE ANÁLISIS
INSTRUMENTAL, 5° ed.; Ed. McGraw-Hill (1998), págs. 219-239.